Homo sapiens (človek) ale aj iné živočíchy vo svojej histórii existencie boli už veľa krát vystavení smrteľnému útoku najmenších predátorov tejto planéty Zem, vírusom a baktériám. Z mikrosveta sa vždy po určitom období vynorí smrteľný nano alebo mikro predátor, ktorému nič nie je sväté. Bez milosti zabíja starých ľudí ale nepohrdne aj mladými.
„SARS-CoV nebezpečný agens pre homo sapiens a možno aj pre teplokrvné živočíchy planéty“ Jusko Peter, NCDs clinic, Bratislava

Presne pred 100 rokmi na pyrenejskom polostrove sa objavila chrípková nákaza, ktorej prischlo nazvanie španielska chrípka. Odhaduje sa, že španielskou chrípkou sa nakazilo medzi januárom 1918, kedy sa začala masovo šíriť a decembrom 1920, kedy je zaznamenaný koniec pandémie, viac ako 500 miliónov ľudí, čo bola štvrtina vtedajšej svetovej populácie. Coronavirus „útočí“ približne od novembra 2019 a počet úmrtí k dnešnému dňu ukazuje „worldometer“. Ak porovnáme počet populácie na svete počiatkom 20 storočia k populácií ľudí na počiatku 21 storočia, počet úmrtí na vírus SARS-CoV v porovnaní na španielsku chrípku je dosť nízky.
Vírus hostiteľská bunka interakcia
Na to, aby sme mohli odhadnúť možne sa chovanie vírusu, je potrebné poznať jeho životnosť a hlavne mechanizmus množenia, nakoľko tieto parametre predurčujú jeho agresivitu. Predtým, ako sa pokúsim kvalifikovane posúdiť a vyhodnotiť agresívnosť vírusu SARS-CoV, vrátim sa ešte raz na začiatok 20 storočia. Keď na západe Európy v tej dobe pustošil chrípkový vírus obyvateľstvo, na východe, v bývalom Sovietskom zväze sa vedci a lekári začali zaoberať myšlienkou využitia vírusov na boj s infekciami. Tento stimul prišiel z Paríža ale udomácnil sa až do dnešných dní v Rusku.
Na počiatku septembra 1917 roku, mikrobiológ Felix d’Herelle, zamestnanec Pasteurovho inštitútu oznámil, že objavil neviditeľný mikrób, ktorý zabíja bacil dyzentérie. Herelle publikoval svoje pozorovania a navrhol, že „lýza“ bacilu bola spôsobená „neviditeľným mikrobiálnym antagonistom bacilu dyzentérie“. Pozorovaný agens, ktorý bol schopný lýzovať bacil dyzentérie, d’Herell nazval bakteriofágom, čo znamená „požierač baktérie.“ V svojej podstate „bakteriofág“ je vírus, ktorý využíva baktériu (jednobunkový živočích) na svoje rozmnožovanie a vírus SARS-CoV naopak, využíva zvieraciu alebo ľudskú bunku na svoju replikáciu – množenie. Môžeme povedať, že dnes teda poznáme „dobré“ ako aj „zlé“ vírusy. Dobré vírusy „bakteriofágy“ pri použití môžu zabiť v našom tele nebezpečné baktérie, ktoré sú zdrojom mnohých toxínov, ktoré s ľahkosťou stimulujú imunitnú reakciu organizmu.
Štruktúra vírusu a proces množenia
Vzor „dobrého“ vírusu – bakteriofága je zobrazený na obrázku 1. Bakteriofágy sú vysoko špecifické vírusy, ktoré napadajú iba baktérie t.j. jeden druh bakteriofágu selektívne napadá len jeden druh baktérii. Ľudovo povedané „nelezú si do kapusty“.
„Zlé“ vírusy sa správajú podobne avšak od „dobrých“ vírusov sa odlišujú tým, že napadajú bunky tkanív orgánov zvierat a/alebo ľudí. Napríklad vírus hepatitídy A/B/C/D/E miluje bunky pečene, ľudský papilomavírus najčastejšie typ 6, 11 a 16, 18 napadá bunky krčka maternice, herpes vírus je zase skupina vírusov (herpes simplex typ 1 a 2, varicella zoster, cytomegalovírus a EpsteinovBarrovej vírus) napádajúca predovšetkým epiteliárne bunky slizníc. Corona vírus SARS-CoV (obrázok 2) napadá predovšetkým sliznicové epiteliárne bunky horných dýchacích ciest a pľúc.
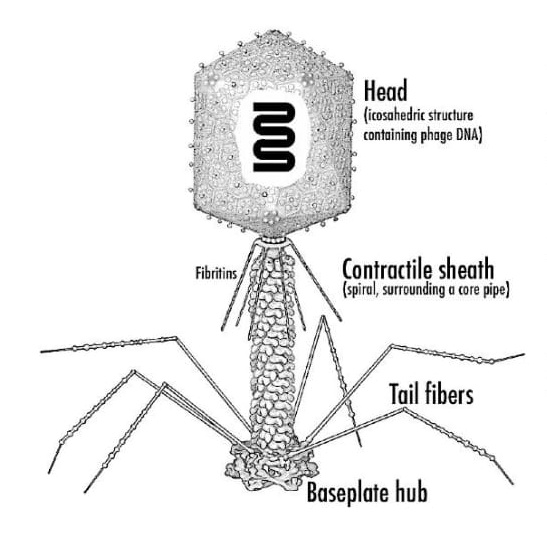
Obr. 1. Schematické znázornenie prototypovej bakteriofágovej častice
Bakteriofágová DNA je chránená ikosahedrálnou kapsidou, ktorá je pripojená k kontraktilnému plášťu, vysoko špecializovanej a mimoriadne účinnej fágovej zložky potrebnej na infikovanie svojho hostiteľa. Šesťuholníková základná doska je umiestnená na distálnom konci kontraktilného plášťa a koordinuje pohyb koncových vlákien, ktoré spočiatku snímajú prítomnosť hostiteľa pomocou krátkych chvostových vlákien, ktoré sa rozvinú zo spodnej základovej dosky, aby pevne zakotvili na svojom bakteriálnom povrchu hostiteľa, a špirálovité sťahovacie puzdro obklopujúce jadrovú rúrku, ktorá sa sťahuje, a vylučuje DNA do bakteriálneho hostiteľa. Prevzaté z [1]
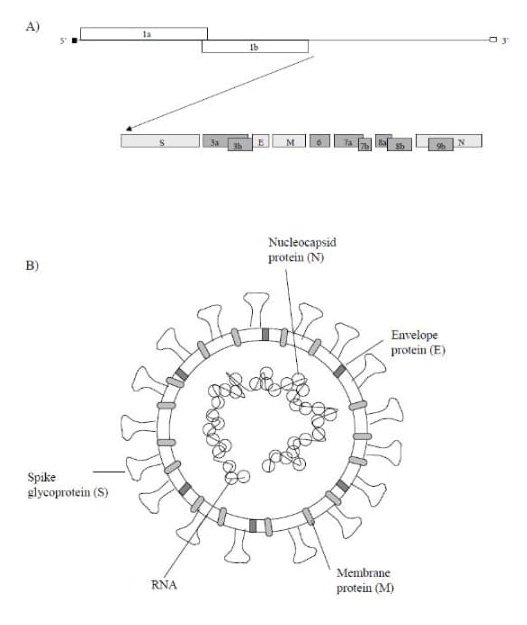
Obr. 2. Schematický nákres SARS-CoV genómu A) a virionu B)
ŠTRUKTURÁLNE PROTEÍNY
Hroty na obálke sú zložené z troch monomérov vírusových S glykoproteínov a sprostredkujú väzbu receptora a fúziu vírusu s hostiteľskou bunkou. Proteín S SARS-CoV má ~1200 amino kyselín v dĺžke ~180 kiloDaltonov (kD) a môže sa rozdeliť na dve podjednotky, S1 a S2. Doména S1 na N-konci tvorí hlavovú oblasť obsahujúcu doménu viažucu receptor (RBD), ktorá je umiestnená blízko karboxyterminálu S1 a je zodpovedná za väzbu na bunkový receptor. Hlavný bunkový receptor bol identifikovaný ako enzým konvertujúci angiotenzín 2 (ACE2) pre SARS-CoV. Avšak neintegrín zachytávajúci integrín ICAM-3 špecifický pre pečeň / lymfatickú uzlinu (L-SIGN) nachádzajúci sa na dendritných bunkách (DC) môže tiež fungovať ako alternatívny receptor pre SARS, ale má menšiu receptorovu aktivitu ako ACE. Doména S2 tvorí oblasť stonky a je zodpovedná za fúziu vírusového obalu a bunkovej membrány. Mnoho koronavírusov je štiepených furínovými proteázami za vzniku jednotky S1 a S2, avšak S glykoproteíny SARS-CoV sa neštiepia furínom a zdá sa, že neobsahujú furínové štiepne miesto. Štiepenie S sa s najväčšou pravdepodobnosťou uskutočňuje endozomálnymi proteázami katepsínu L, ale môže sa štiepiť aj trypsínom. Všetky podrobnosti o štrukturálnych proteínov, pomocných proteínov, replikácii môže čitateľ nájsť na stranách 18 – 24 dizertačnej práce Sara Akerstrom, Karolinsky Inštitut, Štokholm, Švedsko [2].
REPLIÁCIA SARS-CoV VÍRUSU
Po naviazaní S proteínu na ACE2, hlavný receptor pre SARS-CoV na hostiteľskej bunke, sa vírus prenesie prostredníctvom endocytózy sprostredkovanou receptorom do endozómov. Vyššie uvedená ko-expresia ACE2 a alternatívneho receptora L-SIGN bola nájdená v pľúcnych tkanivách u ľudí infikovaných SARS-CoV, ktorý zomreli…. str. 22-23 dizertácie [2].
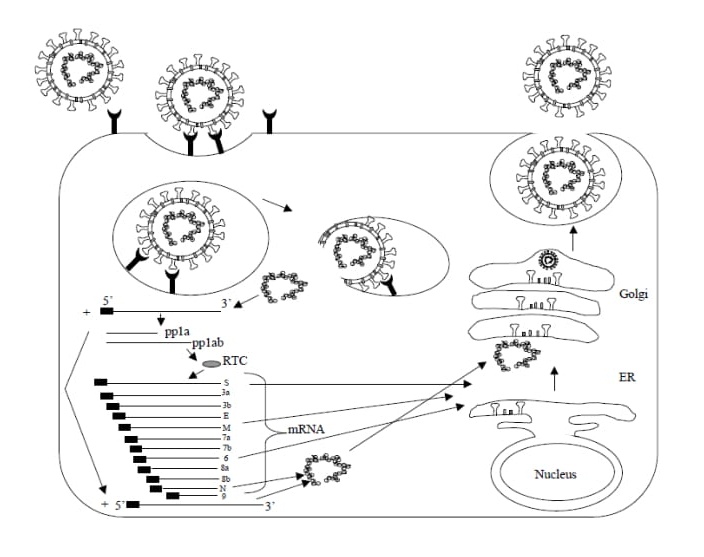
Obr. 3. Replikačný cyklus SARS-CoV
![Obr. 4. Schéma lytického cyklu bakteriofága T4 podľa Eshelman et al., 2010 [3]](https://clanky.info/wp-content/uploads/2020/06/obr.4-Schema-lytickeho-cyklu-bakteriofaga-T4.jpg)
Obr. 4. Schéma lytického cyklu bakteriofága T4 podľa Eshelman et al., 2010 [3]
Vírus SARS-CoV sa však celý premiestni do hostiteľovej bunky prostredníctvom mechanizmu endocytózy a keď sa nasyntetizuje nový jedinec, ten prostredníctvom exocytózy sa dostáva von z bunky do extracelulárneho priestoru (ECM), kde okamžite napadá ešte neobsadenú bunku. Tuná hovoríme o súper vírusu, nakoľko jeden vírus si obsadí jednu bunku a množí sa pokiaľ bunka materiálovo – energetický zvláda replikovať nové vírusy alebo dovtedy, pokiaľ imunitný systém ju nezlikviduje.
A v tomto bode nastáva najväčší problém. Aj keď dnes vidíme, že SARS-CoV zabíja predovšetkým starých ľudí, z pohľadu rozširovania sa tejto vírusovej infekcie najväčšie nebezpečenstvo predstavujú práve mladý ľudia vo veku od 15 do 40 až 45 rokov. U týchto mladých ľudí sa imunitný systém vie vysporiadať s vírusom tak, že priebeh sa javí ako latentný t.j. bezpríznakový. Je to dané predovšetkým tým, že imunitný systém stíha dlhodobo likvidovať nové embria koronavírusu a zároveň u mladých ľudí početnosť výskytu bakteriálnych infekcii v porovnaní k staršej populácii je dosť nízky.
V nasledujúcom videu si viete nastaviť automatické titulky:
Likvidácia SARS-CoV
Na klinike „NCDs clinic“ sa používa prístroj „Plason“, ktorý je generátorom fyzikálnej plazmy obsahujúcej v ppm množstvách oxid dusnáty. NO-terapia sa využíva pri liečbe otvorených nehojacich sa rán, najčastejšie u diabetikov, ulcerózne rany, otvorené rány po mechanickom poškodení. Okrem bakteriálnych infekcii dostatok pacientov prišlo s vírusovými problémami, medzi ktorými dominovali herpes vírusy, varicella zoster a papiloma vírusy. Zaznamenali sme, že oxid dusnatý vie zlikvidovať vírusovú infekciu absolútne, nakoľko recidíva sa neobjavila v priebehu 3 rokov.
To mi dalo dôvod pohľadať na internete v medicínskych žurnálov odborný článok, ktorý by sa venoval oxidu dusnatému ako možnému likvidátorovi vírusu SARS-CoV. Bol som v šoku, keď ako prvý článok sa objavila práve dizertačná práca Sari Akerstrom [2]. ta na strane 20 v kapitole 3 sa venuje oxidu dusnatému, ako významnej molekule produkovaného aj bunkami imunitného systému.
Akerstrom uvádza, že „…Vysoká úroveň produkcie NO by mohla byť súčasťou patogénnych dôsledkov rôznych chorôb. Predpokladá sa, že NO prispieva k patogenéze pneumónie vyvolanej vírusom chrípky. Uvádza sa tiež, že oxid dusnatý má antivírusový účinok na vírusy DNA a RNA, ako je vírus Epstein-Barr (EBV), vírus japonskej encefalitídy (JEV), konžského vírusu hemoragickej horúčky (CCHFV) a hantavírusy. Mechanizmus antivírusového účinku oxidu dusnatého nie je v súčasnosti známy. Existuje však niekoľko správ, ktoré stanovili mechanizmus inhibície oxidu dusnatého. Ukázalo sa, že oxid dusnatý inhibuje enzymatickú aktivitu vírusovej proteázy 3CPro S-nitrosyláciou cysteínových zvyškov v aktívnom mieste vírusovej proteázy. 3CPro je rozhodujúci pre vírusový životný cyklus coxsackievírusu. Okamžitý skorý transaktivátorový proteín Zta je deregulovaný oxidom dusnatým, ktorý pomáha udržiavať latenciu EBV. Oxid dusnatý sa ukázal nepriamym mechanizmom na zníženie palmitoylácie potkanieho myelínového proteolipidového proteínu.
- Držiteľ Nobelovej ceny za medicínu z roku 1998 Dr. Ignarro vo svojej knihe: Program Ano NO (oxid dusnatý) skutočný záchranca života, došiel k záveru, že rozdiel medzi zdravím a chorobou je často otázkou toho, na akej úrovni NO vo Vašom tele funguje.
- Vedecký objav storočia – pôsobenie zázračnej molekuly oxidu dusnatého – výsledky a poďakovania ľudí
- Ďalší článok: Účinnosť oxidu dusnatého v boji proti COVID-19
Inhalácia oxidu dusnatého bola schválená Úradom pre potraviny a liečivá USA v 1999 a v roku 2001 Európskou agentúrou pre hodnotenie liekov a Európskou komisiou. Endogénny a exogénny produkovaný oxid dusnatý má za následok nadmerné množstvo odpovedí v pľúcach, ako je vazorelaxácia a bronchodilatácia. Použitie inhalovaného oxidu dusnatého viedlo k zlepšeniu okysličenia novorodencov s pretrvávajúcou pľúcnou hypertenziou. Pľúcna vazokonstrikcia sa u jahniat zlepšila inhaláciou oxidu dusnatého, čo viedlo k pľúcnej vazodilatácii. U pacientov s akútnym respiračným syndrómom (ARDS) liečba inhalovaným oxidom dusnatým zlepšila okysličovanie a znížila pľúcny syndróm (HPS) a viedla k zlepšeniu okysličenia. Inhalácia oxidu dusnatého bola vyskúšaná iba u niekoľkých pacientov s diagnózou SARS-CoV, ale s priaznivým účinkom“.
To všetko už bolo opublikované v 2008 roku a dnešný špecialisti v masmediach vyprávajú nezmysli o nemožnosti liečiť pacientov infikovaných vírusom SARS-CoV. Spoločnosť Onkocet s.r.o., zaregistrovala v EU prístroj Plason, ktorý generuje oxid dusnatý už v 2008 roku. Záujem o využitie tohto prístroja v štátnych zariadeniach do dnešného dňa je prakticky nulová.
V tomto roku sme priviezli pre potreby NCDs clinic aj bakteriofágovy kokteil SEXTAFAG od spoločnosti Microgen. Liečivo Sextafag predstavuje polyvalentný pyobakteriofág so schopnosťami špecificky lyzovať baktérie kmeňa Staphylococcus, Streptococcus (vrátane Enterococcus), Proteus, Klebsiella pneumoniae, Pseudomonas aeruginosa a Escherichia coli a je určené na prevenciu hnisavo-zápalových a enterálnych ochorení.
Bakteriofágy sú malé vírusy schopné usmrtiť baktérie neovplyvňujúc iné bunkové línie. (Small viruses able at killing bacteria while they do not affect other cell lines)
ZÁVER
Oxid dusnatý spolu s Sextafagom dáva akú-takú šancu na prežitie aj ľuďom vyššieho veku.
Autor: Jusko Peter, NCDs clinic, Bratislava
Literatúra
[1] Harada K.L. et al.//Biotechnological applications of bacteriophages: State of the art. Microbiological Research, Volumes 212–213, July–August 2018, Pages 38-58
[2] Sara Akerstrom, SARS CORONAVIRUS. The role of accessory proteins and nitric oxida in the replication cycle. Karolinska Institutet, Stockholm 2008, Sweden.
[3] Eshelman, C.M. et al., 2010. Unrestricted migration favours virulent pathogens in experimental metapopulations: evolutionary genetics of a rapacious life history. Philosophical transactions of the Royal Society of London. Series B, Biological sciences, 365, pp.2503–2513.
Dr. Hricika budete môcť osobne stretnúť na akcii: